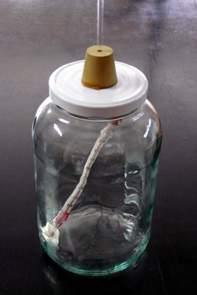
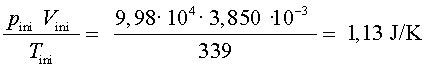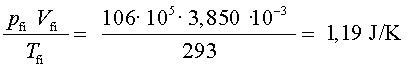7) Muntem el cèrcol en el suport, a l’extrem
superior de la barra. Posem el recipient invertit damunt del cèrcol,
de manera que el tub vagi a l’interior d’una proveta plena
d’aigua. El muntatge ja està llest per fer l’experiment
(vegeu les figures 5 i 7).
Experiment 1
1. Destapem el recipient de
vidre.
2. Amb l’assecador
de cabell escalfem l’aire durant tres o quatre minuts. Convé
no apuntar directament cap al termòmetre. Interessa que la
temperatura arribi a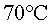 o
o 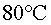 i
que les parets del recipient també estiguin calentes, en equilibri
tèrmic amb l’aire, dins del que sigui possible. i
que les parets del recipient també estiguin calentes, en equilibri
tèrmic amb l’aire, dins del que sigui possible.
3. Tapem el recipient, llegim
les temperatures del dos termòmetres, el girem ràpidament
(compte, necessitarem guants!) i el col•loquem damunt del cèrcol,
amb el tub dins de la proveta.
4. A partir d’aquest
moment l’aire de dins del pot es refreda i l’aigua comença
a pujar pel tub. La proveta es va buidant i l’aigua entra al
recipient de vidre.
5. Ho deixem refredar fins
a la temperatura ambient.
6. Llegim la temperatura
final i mesurem el desnivell de líquid entre la proveta i el
pot de vidre.
7. Llegim la pressió
atmosfèrica al baròmetre del laboratori ( vegeu la figura
6).
8. Observem que la temperatura
de l’aire ha disminuït i la seva pressió també.
Ja podem fer els càlculs corresponents i analitzar els resultats
en relació amb la llei dels gasos ideals: 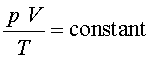
|
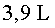 );
es pot comprar a la botiga Torrero
i Mas o a basars.
);
es pot comprar a la botiga Torrero
i Mas o a basars.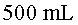




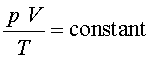




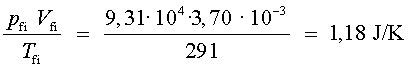
 s’ha
mantingut constant (dins d’uns marges d’error raonables), tal com
diu la llei dels gasos ideals.
s’ha
mantingut constant (dins d’uns marges d’error raonables), tal com
diu la llei dels gasos ideals.