Estem acostumats, de sempre, a pesar les coses amb una balança. Ara
bé, podem utilitzar-la per pesar gasos? Veurem que sí, sempre
que prenguem en consideració factors que habitualment no tenim en compte.
Podem pesar butà, ![]() ,
hidrogen... Això ajudarà els alumnes d'ESO a considerar els gasos
com una substància "real" . Els de batxillerat ho podran relacionar
amb l'assignatura de Química i treballar la llei dels gasos ideals.
,
hidrogen... Això ajudarà els alumnes d'ESO a considerar els gasos
com una substància "real" . Els de batxillerat ho podran relacionar
amb l'assignatura de Química i treballar la llei dels gasos ideals.
Primera part:
|
 |
CàlculsLa balança mesura la massa aparent
és a dir, al pes real de tot l'objecte menys l'empenyiment d'Arquimedes, a causa de l'aire que l'envolta. La massa de
Una manera habitual de procedir és tarar la balança
per no anar arrossegant tota l'estona la massa de l'ampolla, tal com s'indica
al punt 3. Fer això equival a considerar
Mirem-ho d'una altra manera: hem substituït aire per
Utilitzarem la llei dels gasos ideals per calcular la massa de l'aire: |
 |
recordem que n és el nombre de mols, m la massa de gas i M la massa d'un mol de gas. Podem aïllar la massa i escriure
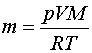
Aplicat al nostre cas, en què V
= 1,5 L, ![]() ,T
= 20ºC = 293 K i p=1,00
atm (o la temperatura i pressió que hi hagi al laboratori)
,T
= 20ºC = 293 K i p=1,00
atm (o la temperatura i pressió que hi hagi al laboratori)
Amb això 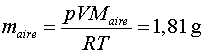
i finalment ![]() , en
gram.
, en
gram.
Si dividim aquesta massa entre el volum de l'ampolla, podrem trobar la densitat
experimental del ![]() ,
,![]() ,
i comparar-la amb la teòrica
,
i comparar-la amb la teòrica![]() :
:
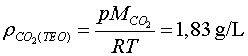 .
.
En l'experiment que hem fet nosaltres (vegeu la figura 2) ![]() ,
per tant,
,
per tant,
![]() ;
; 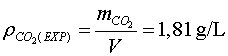
així hi ha una discrepància entre els dos valors al voltant del 1%.
Segona part: hidrogenL' hidrogen és més lleuger que l'aire; per tant, haurem
de treballar amb l'ampolla invertida. La reacció és molt
exotèrmica i la temperatura puja força. Això fa que
l'hidrogen produït en la reacció estigui mesclat amb vapor
d'aigua. Si aquesta mescla entra directament a l'ampolla, el vapor s'hi
condensa i la balança dóna una lectura poc fiable. 1) Tallem una ampolla de plàstic per la meitat.
Hi fet un forat gran a cada costat per passar el tub de goma i la pinça.
Això farà de suport a l'ampolla invertida. Compte:
ni el tub ni la pinça han de tocar les ampolles! |
 |
Càlculsigual que abans
En el nostre cas tenim ( vegeu la figura 4)
que ens dóna una densitat experimental de amb una discrepància del 5%
entre els dos resultats. Convé observar que la massa de l'hidrogen
és una quantitat petita obtinguda per diferència entre dues
de molt més grans. Per tant, un petit error en el que realment
mesurem amb la balança ( |
 |
Tercera part: experiències qualitativesPer acabar, podem fer unes experiències qualitatives (per l'ESO) amb aquests gasos, per exemple: 1) Posem una espelma encesa dins d'un vas de precipitats
gran. Posem un embut damunt del vas. Tirem a l'embut el |
Autor d'aquesta pàgina: Josep Ametlla, professor de física i química del IES Ausiàs March.
Aquesta
obra està subjecta a una
Llicència
de Creative Commons
![]()